Chaleur latente définition
La chaleur latente est la quantité d’énergie qui est nécessaire pour faire passer un corps dans son état supérieur. Par exemple de l’état solide vers liquide, ou liquide vers gazeux. Le graphe suivant permet de bien différentier la chaleur sensible de la chaleur latente.
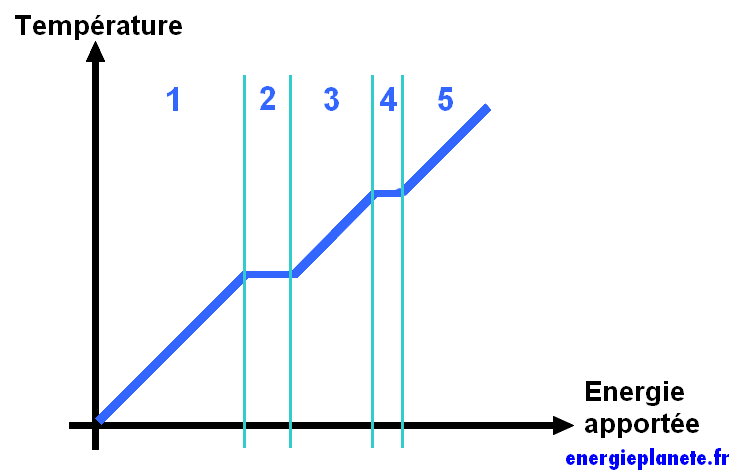
Dans la zone 1, l’énergie apportée au corps (solide) est stockée sous forme sensible : il se réchauffe. En zone 2, il se liquéfie ; l’énergie est stockée sous forme latente, sa température est constante. En zone 3, le corps (liquide) se réchauffe, l’énergie est stockée en sensible. En 4, le corps s’évapore, l’énergie est stockée en latent. Puis en 5, le corps (gazeux) recommence à chauffer.
On constate ainsi que la liquéfaction et l’évaporation se produisent à température constante, alors que l’on apporte tout de même de l’énergie au corps. Cette énergie est en réalité stockée sous forme latente.
Ces deux réactions sont dites endothermiques (elles absorbent de l’énergie). Pour la récupérer, il faut refaire passer le corps chauffé dans un état inférieur. La liquéfaction (gaz vers liquide) ou encore la solidification sont des phénomènes exothermiques (ils rejettent de la chaleur).
Cette quantité d’énergie stockée peut elle aussi se quantifier assez simplement. Il faut connaître cette fois-ci l’énergie de changement d’état du corps. Ainsi, si l’on choisit de stocker de l’énergie en évaporant une tonne d’eau (chaleur latente d’évaporation = 2250kJ/kg), on pourra stocker :
Énergie stockable = 2250 x 1000 = 2250MJ
On constate que la valeur est très grande (à comparer avec le sable vu précédemment). L’eau est en effet connue pour avoir une très grande énergie de changement d’état.
Exemples chaleur latente
Dans les pompes à chaleur, le fluide caloporteur doit pouvoir emmagasiner de l’énergie lorsqu’il est au contact de l’air extérieur. Or ce dernier est très froid. On s’arrange donc pour que le fluide s’évapore à la température extérieur (en jouant sur sa pression) ; il peut ainsi capter beaucoup d’énergie, sans que sa température n’augmente pour autant. Une fois au contact de l’eau de chauffage dans la maison), il va se liquéfier, et céder la chaleur pompée dehors.
Les matériaux à changement de phase reposent eux aussi sur ce principe. Dans l’habitat, ils emmagasinent en fondant de l’énergie en journée, lorsque le soleil tape, sans que le local ne chauffe trop. Lorsque le soleil se couche, il repasse à l’état solide, et diffuse l’énergie accumulée. La consommation d’énergie est lors réduite, et le confort meilleur.
Pour aller plus loin lire les articles suivants
Inertie c’est quoi ?
Inertie définition Il est également possible d’envisager un stockage d’énergie sous forme d’énergie cinétique. En effet, tout corps qui possède…
Énergie potentielle de pesanteur
Énergie potentielle de pesanteur définition L’énergie potentielle de pesanteur (EPP) est basée sur le principe de la gravitation. En effet,…
Chaleur sensible c’est quoi ?
Chaleur sensible définition Comme son nom l’indique, la chaleur sensible est celle que l’on peut… sentir ! Sentir en la touchant….